Član 1.
Određivanje pH vrednosti i količine toksičnih metala i nemetala i mikrobiološke ispravnosti radi utvrđivanja zdravstvene ispravnosti sredstava za održavanje lične higijene, negu i ulepšavanje lica i tela vrši se po metodama koje su odštampane uz ovaj pravilnik i čine njegov sastavni deo.
Član 2.
Pod sredstvima za održavanje lične higijene, negu i ulepšavanje lica i tela, u smislu ovog pravilnika, podrazumevaju se:
1) sredstva koja dolaze u dodir sa sluzokožom (sredstva za čišćenje i negu zuba, usne šupljine, ulepšavanje i bojenje usana i očiju i intimnu higijenu);
2) sredstva koja ostaju duže vreme na koži (sredstva za negu i zaštitu kože, bojenje i ulepšavanje lica i tela, parfimisanje, kao i dezodoransi i antiperspiransi);
3) sredstva koja se posle kratkog vremena odstranjuju se kože ili se koriste za negu i ulepšavanje kose ili noktiju (sredstva za pranje i čišćenje lica i tela, pranje i negu kose, brijanje, bojenje i ulepšavanje noktiju i kose i depilatori).
Član 3.
Količina toksičnih metala i nemetala određuje se spektrofotometrijskim metodama i metodama atomsko-apsorpcione spektrofotometrije kao alternativnim metodama.
Tim metodama se obuhvata:
1) određivanje količine žive;
2) određivanje količine kadmijuma;
3) određivanje količine arsena;
4) određivanje količine olova;
5) određivanje količine hroma;
6) određivanje količine nikla;
7) određivanje količine barijuma.
Član 4.
Svi reagensi koji se upotrebljavaju za hemijske analize moraju biti čistoće pro analusi, a voda mora biti destilovana ili redestilovana.
Član 5.
Metodama za određivanje mikrobriološke ispravnosti sredstava za održavanje lične higijene, negu i ulepšavanje lica i tela obuhvaćeno je:
1) određivanje ukupnog broja mezofilnih aerobnih mikroorganizama i ukupnog broja kvasaca i spora plesni;
2) identifikacija sledećih mikroorganizama:
– Staphulococcus aureus;
– Pseudomonas aeruginosa;
– Escherichia coli;
– Proteus vrste.
Član 6.
Ovaj pravilnik stupa na snagu osmog dana od dana objavljivanja u „Službenom listu SFRJ”.
08 Br. 865
16. aprila 1983 . godine
Beograd
Predsednik
Saveznog komiteta za rad, zdravstvo i
socijalnu zaštitu,
dr Đorđe Jakovljević, s.r.
Metode za određivanje pH vrednosti, količine toksičnih metala i nemetala i mikrobiološke ispravnosti u sredstvima za održavanje lične higijene i negu i ulepšavanje lica i tela
A. METODA ODREĐIVANjA pH VREDNOSTI
1. Princip
Određivanje pH vrednosti vrši se potenciometrijski, a zasniva se na merenju promene potencijala merne elektrode zavisno od koncentracije vodonikovih jona ispitivanog uzorka.
Merenje se vrši direktno u uzorku ili u rastvoru dobijenom posle pripremanja uzorka prema propisanom postupku.
2. Aparatura
1) pH metar, staklena i referentna elektroda ili kombinovana elektroda
2) Električno vodeno kupatilo ili električna ploča s termoregulacijom
3) Laboratorijska centrifuga (ako je potrebno)
3. pH standardi
pH metar se baždari pH standardima, puferskim rastvorima pripremljenim prema NBS, koji se koriste gotovi ili se mogu pripremiti na sledeći način: Ftalatni pufer (0,05 mol/l KHC8H4O4) – pH 4,008 (25°S) 10,21 g kalijum-hidrogen-ftalata rastovri se u približno 800 ml vode i dopuni vodom do 1000 ml. Pre merenja, kalijum-hidrogen-ftalat suši se dva časa na temperaturi 110 do 130°S.
Fosfatni pufer (0,025 mol/l KH2PO4+0,025 mol/l Na2HPO4) – pH 6,865 (25°S)
3,388 g kalijum-dihidrogen-fosfata i 3,533 g natrijum-hidrogen-fosfata rastvori se u približno 800 ml vode i dopuni vodom do 1000 ml. Pre merenja, natrijum-hidrogen-fosfat suši se dva časa na temperaturi 110 do 130°S.
Boratni pufer (0,01 mol/l Na2B4O7 10 H2O) – pH 9,180 (25°S) 3,813 g natrijum-tetraborata rastvori se u približno 800 ml vode i dopuni vodom do 1000 ml. Rastvor treba zaštiti od ugljen-dioksida iz vazduha.
pH standardi obnavljaju se svakih mesec dana. Povećanje broja mikroorganizama sprečava se dodavanjem zrna timola na litar rastvora.
4. Prečišćena voda
Voda koja se koristi za pripremanje pH standarda, kao i za pripremanje uzorka za merenje (osim kad je drugačije propisano), mora biti sveže prokuvana (vreme ključanja 5 do 10 minuta) i prečišćena (destilovana ili demineralizovana), sa pH vrednošću 5,5 do 7,0.
5. Model-rastvor sličan znoju
Reagensi
1) Rastvor natrijum-hlorida (NaCl): 10,0 g natrijum-hlorida rastvori se i dopuni vodom do 1000 ml.
2) 0,1% v/v sirćetne kiseline (C2H4O2).
3) Rastvor natrijum-acetata (NaC2H3O2) : 100 mg NaC2H3O2 rastvori se i dopuni vodom do 100 ml.
Postupak
Model-rastvor priprema se tako što se pH vrednost rastvora natrijum-hlorida podesi na 5,5 dodavanjem sirćetne kiseline (0,1% v/v) ili rastvora natrijum–acetata.
6. Određivanje pH vrednosti u sredstvima za održavanje lične higijene, negu i ulepšavanje lica i tela (dalje u tekstu: kozmetička sredstva)
Za određivanje pH vrednosti kozmetička sredstva dele se u grupe prema tipu i na osnovu primene sredstava.
6.1. Kozmetička sredstva koja nisu emulzije, a sadrže vodu
1) Sredstva koja se prilikom primene razređuju vodom (npr. šamponi, zubne paste, toaletni sapuni itd).
Merenje se vrši u rastvoru posle odvajanja taloga.
Pripremanje uzorka: u 5 g uzorka doda se 95 ml vode i meša staklenim štapićem dok se uzorak rastvori, odnosno dok nastane homogena suspenzija.
Bistri rastvor dobija se centrifugiranjem ili sedimentiranjem i dekantovanjem.
2) Sredstva koja se prilikom primene ne razređuju vodom (npr. kolonjske vode, parfemi, alkoholni losioni, gel, dezodoransi, maske itd).
Merenje se vrši direktno, bez posebnog pripremanja uzoraka.
6.2. Kozmetička sredstva – emulzije
1) Emulzije tipa ulje u vodi (npr. kreme, tečne emulzije za negu ili zaštitu, losioni i mleka za čišćenje, emulzije za šminkanje itd.). Merenje se vrši direktno, bez posebnog pripremanja uzoraka.
2) Emulzije tipa voda u ulju (npr. kreme za negu ili zaštitu, tečne emulzije itd.).
Merenje se vrši u vodenoj fazi, posle ekstrakcije jednog dela uzorka sa pet delova vode.
Pripremanje uzorka: u 5 g uzorka doda se 25 ml vode i zagreva 10 minuta na temperaturi od 60°S, uz mešanje staklenim štapićem. Posle hlađenja, odvoji se vodena faza od uljane faze.
6.3. Kozmetička sredstva koja ne sadrže vodu i prilikom primene se ne razređuju vodom (npr. posipi, puderi, šminka za lice, oči i usne, čvrsti dezodoransi, olovke itd.).
Merenje se vrši u rastvoru posle ekstrakcije jednog dela uzorka sa 10 delova model-rastvora sličnog znoju.
Pripremanje uzorka: u 5 g isitnjenog uzorka doda se 50 ml model-rastvora sličnoj znoju i zagreva se 5 minuta na temperaturi od 40°S, uz mešanje staklenim štapićem.
Posle hlađenja, bistri rastvor se dobija centrifugiranjem ili sedimentiranjem i dekantovanjem.
Napomena: pH vrednost ispitivanog uzorka meri se na sobnoj temperaturi, na pH metru baždarenom na istoj temperaturi.
pH vrednost se određuje u najmanje tri uzorka jedne serije i predstavlja srednju vrednost merenja.
B. Metode određivanja količine toksičnih metala i nemetala u kozmetičkim sredstvima (spektrofotometrijske metode)
Pripremanje uzorka za određivanje količine toksičnih metala i nemetala metodom ekstrakcije
Ekstrakcija
Stakleno posuđe, aparatura i ostali pribor
1) Erlenmajer-tikvice sa brušenim čepom zapremine 250 ml.
2) Libitov kondenzator.
3) Menzure, zapremine 100 ml.
4) Odmerne tikvice, zapremine 100 ml.
5) Levak za filtriranje.
6) Filtrir-papir – plava vrpca.
Reagensi
0,1 mol/l hlorovodonična kiselina (HCl).
Postupak
Odmeri se 10,0 g homogenizovanog uzorka u Erlenmajer-tikvicu sa brušenim čepom, zapremine 250 ml, doda 75 ml 0,1 mol/l HCl i zagreva 15 minuta na temperaturi ključanja, uz povratno hlađenje. Kondenzator se ispere s malo destilovane vode, a sadržaj kvantitativno filtrira u odmernu tikvicu zapremine 100 ml mlakom 0,1 mol/l HCl i dopuni istom hlorovodoničnom kiselinom do oznake.
Napomena: Za sve vreme ekstrakcije pH vrednost suspenzije ne sme biti veća od 1,5.
1. Određivanje količine žive
Princip
Količina žive određuje se posle ekstrakcije tako da se živa ekstrahuje pri pH vrednosti 0,5 standardnim rastvorom ditizona u hloroformu. Primenom reverzione tehnike utvrđuje se sadržaj žive iz razlike na spektrofotometru izmerenih apsorbancija boje žućkastomrkog kompleksa živinog ditizonata i zelene boje revertiranog ditizona.
Stakleno posuđe, aparatura i ostali pribor
1) Levak za odvajanje, zapremine 250 i 1000 ml.
2) Graduisane pipete, zapremine 1, 5, 10 i 25 ml.
3) Trbušaste pipete, zapremine 1, 2, 5, 10 ml.
4) Čaše zapremine 50 i 250 ml.
5) Odmerne tikvice, zapremine 50 i 500 ml.
6) Menzre, zapremine 100 i 500 ml.
7) Spektrofotometar.
Napomena:
Sve staklene posude pre početka rada isperu se zagrejanom (70°S) razređenom azotnom kiselinom, zatim destilovanom i redestilovanom vodom, da bi se odstranila eventualno adsorbovana živa iz prethodnog postupka, a zatim se testira ditizonom.
Reagensi
Kao reagensi upotrebljavaju se hemikalije što je moguće višeg stepena čistoće.
1) Amonijum-hidroksid, koncentrovani (NH4OH) – minimalno 25%.
2) Sumporna kiselina (H2SO4) p.a. 10% v/v vodeni rastvor.
3) Hloroform (CHCl3) p.a.
4) Rastvor natrijum-hidroksida (NaOH) : 20 g rastvori se i dopuni destilovanom vodom do 100 ml.
Čišćenje hloroforma
Oko 500 ml hloroforma pomeša se sa 15 ml rastvora natrijum-hidroksida u okrugloj tikvici od pireks-stakla, širokog, dugog grlića, zapremine 1 do 2 l. Tome se doda oko 10 g kristalnog natrijumf-tiosulfata p.a. pa se destiliše, a destilat sakuplja između tačaka ključanja 59,5 i 62°S. Posle toga, destilovani hloroform se još jedanput destiliše, uz dodavanje male količine kristalnog natrijum-tiosulfata, a zatim se osuši bezvodnim natrijum-sulfatom. Na svakih 100 ml bistrog redestilovanog hloroforma doda se 1 ml apsolutnog etanola. Tako stabilizovan hloroform čuva se u Erlenmajer-tikvici od tamnog pireks-stakla zapremine 1 do 2 l na tamnom i hladnom mestu. Ako se hloroform ponovo čisti, ne treba mu dodavati više etanola jer će se zamutiti.
5) Rastvor amonijum-hidroksida (NH4OH): u 4 ml koncentrovanog NH4OH doda se 100 ml destilovane vode.
6) Rastvor kalijum-cijanida (KCN): 10 g kalijum-cijanida rastvori se i dopuni destilovanom vodom do 100 ml.
7) Hlorovodonična kiselina koncentrovana (HCl): minim. 36%.
8) Redestilovana voda.
9) Rastvor ditizona (C6H5N:NCSNHNHC6H5) u hloroformu (rastvor A).
Čišćenje ditizona
30 do 50 mg tehničkog ditizona, tj. difenil-tiokarbazona rastvori se u 100 ml sveže redestilovanog hloroforma u levku za odvajanje, od pireks-stakla. Doda se 250 do 500 ml rastvora NH4OH i nekoliko mililitara rastvora kalijum-cijanida. Zatim se dobro promućka, tako da ditizon pređe u gornju fazu rastvora NH4OH i oboji ga crvenomrkom bojom. Donja hloroformna faza se posle odvajanja slojeva odbaci, doda se 100 ml sveže redestilovanog hloroforma i zakiseli koncentrovanom hlorovodoničnom kiselinom, tako da pH vrednost vodene faze pređe od 10,0 na 1,0. Na taj način sav ditizon ponovo prelazi u hloroform, što se ogleda u pojavi intenzivne plavozelene boje u donjoj fazi, koja je u debljem sloju čak crvenkastoplava. Donja faza se prebaci u drugi levak i ispere redestilovanom vodom do negativne reakcije na hloride. Tako pripremljen rastvor ditizona čuva se u dobro zatvorenoj Erlenmajer-tikvici od pireks-stakla, mrke ili crvene boje, na mračnom mestu, na temperaturi 3 do 5°S, i dugo je stabilna. Od njega se, prema potrebi, priprema razređeni rastvor ditizona za ekstrakciju žive (rastvor V) razređivanjem sveže redestilovanim hloroformom, koji se može čuvati oko 14 dana.
10) Rastvor ditizona u hloroformu (rastvor V): rastvor ditizona u hloroformu (rastvor A) toliko se razredi hloroformom da pri talasnoj dužini maksimalne apsorpcije ditizona, tj. 608 nm u kiveti promera 1 cm, pokazuje na spektrofotometru ekstinkciju oko 0,900.
11) Kalijum-biftalat (C8H5KO4).
12) Kalijum-jodid (KJ).
13) Zasićeni vodeni rastvor natrijumf-tiosulfata (Na2S2O3).
14) Reverzioni rastvor: 10,2 g kalijum-biftalata i 30,0 g kalijum-jodida rastvori se u redestilovanoj vodi, doda se nekoliko kapi zasićenog rastvora natrijum-tiosulfata i dopuni redestilovanom vodom do 500 ml. Taj rastvor se ekstrahuje 3 do 4 puta sa 5 ml rastvora ditizona (rastvor V) i jedanput sa 10 ml čistog hloroforma, koji mora ostati bezbojan.
15) 0,1 mol/l hlorovodonična kiselina (NCl).
16) Standardni rastvor žive (Hg) : 0,0271 g HgCl2 rastvori se u 0,1 mol/l HCl i dopuni u odmernoj tikvici zapremine 100 ml (rastvor I).
Od tog rastvora, koji u 1 ml sadrži 200 µg žive, u odmernu tikvicu zapremine 100 ml otpipetira se 0,5 ml i dopuni (rastvor II); l ml ovog rastvora sadrži 1 µg žive.
Postupak
Odgovarajuća količina ekstrakta uzorka, koja sadrži najmanje 3 µg žive, neutrališe se koncentrovanim NH4OH, a zatim se 10%-nom v/v sumpornom kiselinom pH vrednost podesi na 0,5 i dopuni redestilovanom vodom u odmernoj tikvici zapremine 50 ml. Određena količina tog rastovra prenese se u levak za odvajanje, zapremine 250 ml. Tome se doda 20 ml ditizonskog reagensa (rastvor V) i snažno mućka 1 do 3 minuta. Posle odvajanja faza, polovina (10 ml) donje hloroformne faze veće specifične težine koja je, prema količini stvorenih ditizonata, sivkasto do crvenkastožućkaste boje, prelije se u drugi levak za odvajanje, zapremine 250 ml, a deo preostale količine prepusti se iz prvog levka preko smotuljka hidrofilne vate (koja je prethodno isprana ditizonskim reagensom, pa hloroformom, a zatim osušena i čuvana u čistoj zatvorenoj boci) u kivetu promera 1 cm. U drugi levak, u kome se nalazi polovina hloroformne faza iz prvog levka, doda se 20 ml reverzionog rastvora i snažno mućka tri minuta. Posle odvajanja faza, donji plavozeleni sloj hloroforma sa revertiranim ditizonom takođe se preko smotuljka hidrofilne vate u ispusnoj cevi levka za odvajanje propusti u kivetu promera 1 cm. Rastvor živinog ditizonata sa ditizonom proprocionalan je koncentraciji žive u ispitivanom uzorku, koja se očita iz baždarne krive. Uporedo se radi slepa proba sa svim reagensima osim rastvora uzorka, umesto koga se uzima ista količina 0,1 mol/l HCl, i provede se kroz sve faza otpisanog postupka.
Baždarna kriva
Baždarna kriva priprema se tako što se u četiri levka za odvajanje u kojima se nalazi redestilovana voda svedena 10%-nom v/v sumpornom kiselinom na pH vrednost 0,5, otpipetira 1, 2, 5 i 10 ml standardnog rastvora žive (rastvor II). Tome se doda po 20 ml ditizonskog reagensa (rastvor V) i snažno mućka 1 do 3 minuta. Posle odvajanja, donje hloroformne faze se propuste u kiveti, na već opisani način, i izvrši se merenje. Odnos između uzetih mikrograma žive i intenziteta nastale boje prikazuje se grafički.
Osetljivost metode iznosi 0,5 µg žive u zapremini od 1 ml.
2. Metoda određivanja količine kadmijuma
Princip
Količina kadmijuma određuje se pomoću hloroforma, ekstrakcijom kadmijum-ditizonata iz jako alkalnog rastvora. Intenzitet nastalog ružičastoljubičastog obojenja izmeri se spektrofotometrijski.
Stakleno posuđe, aparatura i ostali pribor
1) Odmerne tikvice, zapremine 100 i 1000 ml.
2) Levkovi za odvajanje, zapremine 100 ml.
3) Menzure, zapremine 25 ml.
4) Graduisane pipete, zapremine 1, 2 i 5 ml.
5) Trbušaste pipete, zapremine 1, 10 i 15 ml.
6) Spektrofotometar.
Reagensi
Kao reagensi upotrebljavaju se hemikalije što je moguće višeg stepena čistoće.
1) Rastvor kalijum-natrijum-tartarat-tetrahidrata (C4H4KNaO6 4 H2O) : 25 g C4H4KNaO6 4 H2O rastvori se i dopuni destilovanom vodom do 100 ml.
2) Rastvor natrijum-hidroksida (NaOH) : 40 g natrijum-hidroksida rastvori se i dopuni destilovanom vodom do 100 ml.
3) Rastvor A: 400 g natrijum-hidroksida (NaOH) i 10 g kalijum-cijanida (KCN) rastvori se u 1000 ml destilovane vode. Rastvor je stabilan mesec dana.
4) Rastvor V: 400 g natrijum-hidroksida (NaOH) i 0,5 g kalijum-cijanida (KCN) rastvori se u 1000 ml destilovane vode.
Rastvor je stabilan mesec dana.
5) Rastvor hidroksilamin-hidrohlorida (H4ClNO): 20 g H4ClNO rastvori se i dopuni destilovanom vodom do 100 ml.
6) Ditizonski rastvor A: 80 g ditizona (C6H5N : N.CS.NH.NH.C6H5) rastvori se u 1000 ml prečišćenog hloroforma.
Napomena:
Čistoća hloroforma proverava se dodavanjem male količine ditizona. Svetlozelena boja, koja pri tom nastaje, mora se zadržati bar 24 časa.
7) Ditizonski rastvor V: 8 mg ditizona (C6H5N : N.CS.NH.NH.C6H5) rastvori se u 1000 ml hloroforma proverene čistoće.
Rastvor se priprema neposredno pre upotrebe.
8) Rastvor vinske kiseline (L (+) – C4H6O6): 2 g vinske kiseline rastvori se i dopuni destilovanom vodom do 100 ml.
9) Rastvor kobalta: 0,10 g kobalt-sulfata (CoSO4 7H2O) i 5 g natrijum-kalijum-tartarata (C4H4KNaO6) rastvori se u malo destilovane vode. Zatim se doda 40 g natrijum-bikarbonata (NaHCO3) rastvorenog u destilovanoj vodi i dopuni destilovanom vodom do 1000 ml.
Rastvor je stabilan nekoliko nedelja.
10) Hloroform p.a. (CHCl3).
11) Standardni rastvor kadmijuma: u odmernu tikvicu zapremine 100 ml izmeri se tačno 0,2371 g kadmijum-acetata (Cd/Ch3COO/2 · 2H2O), rastvori i dopuni sa 0,1 mol/l HCl do oznake (rastvor I).
U odmernu tikvicu zapremine 100 ml otpipetira se 10 ml rastvora I i dopuni sa 0,1 mol/l HCl do oznake (rastvor II).
U odmernu tikvicu zapremine 100 ml otpipetira se 10 ml rastvora II i dopuni sa 0,1 mol/l HCl do oznake (rastvor III). Zatim se u drugu odmernu tikvicu, zapremine 100 ml otpipetira 10 ml rastvora III i dopuni sa 0,1 mol/l HCl do oznake (rastvor IV). Jedan mililitar tog rastvora odgovara 1 µg kadmijuma.
Postupak
Odgovarajuća količina ekstrakta uzorka, koja ne sme da sadrži više do 100 µg kadmijuma, otpipetira se u levak za odvajanje, zapremine 100 ml. Zatim se doda 1 ml rastvora kalijum-natrijum-tartarata, 5 ml rastvora A, 1 ml rastvora hidroksilamin-hidrohlorida i 15 ml ditizonskog rastvora A i snažno se promućka. Hloroformski sloj prenese se odmah u drugi levak za odvajanje, zapremine 100 ml, u kome se nalaze 25,0 hladnog rastvora vinske kiseline. Ekstrakcija se ponovi sa 10 ml ditizonskog rastvora A, a hloroformski sloj se prenese u levak s vinskom kiselinom. Hloroformski ekstrakt mućka se 2 minuta s vinskom kiselinom da bi kadmijum prešao u vodenu fazu, a hloroformski sloj se odbaci. Zatim se doda 0,25 ml rastvora hidroksilamin-hidrohlorida, 15 ml ditizonskog rastvora B i 5 ml rastvora V i mućka jedan minut. Kad se slojevi odvoje, hloroformski ekstrakt filtrira se preko komadića vate u kiveti promera 1 cm.
Apsorbancija se meri pri talasnoj dužini 518 nm, uz slepu probu, koja se priprema po istom postupku. Vrednost za eventualni sadržaj kadmijuma u uzorku dobija se ekstrapolacijom iz baždarne krive.
Napomena:
Ako je u uzorku zastupljen talijum, postupa se na sledeći način: hloroformski ekstrakti prve ekstrakcije mućkaju se 2 minuta sa 25 ml rastvora kobalta, koji raslaže talijum-ditizonat i stvara kobalt-ditizonat, dok kadmijum-ditizonat ostaje nepromenjen. Hloroformski sloj prenese se u drugi levak za odvajanje, zapremine 100 ml, u kome se nalazi 25 ml rastvora vinske kiseline. Rastvor kobalta pomeša se sa još 5 ml ditizonskog rastvora V i mućka 2 minuta, a zatim se hloroformski sloj prenese u levak sa vinskom kiselinom. Postupak se nastavlja na već opisani način.
Baždarna kriva
Baždarna kriva priprema se tako što se u nekoliko levkova za odvajanje, zapremine 100 ml, otpipetira po 25 ml rastvora vinske kiseline, 0,25 ml rastvora hidroksilamin-hidrohlorida, 15 ml ditizonskog rastvora V i po 0,5 ml; 1,0 ml; 1,5 ml i 2,0 ml rastvora IV. Postupak se nastavlja na opisani način.
Osetljivost metode iznosi 1 µg kadmijuma u zapremini od 25 ml.
3. Određivanje količine arsena
Princip
Količina arsena određuje se posle ekstrakcije, tako da se arsen, u rastvoru sumporne kiseline sa cinkom, reducira u arsin. Arsin se apsorbuje u rastvoru srebro-dietil-ditiokarbamata u piridinu. Intenzitet ljubičastocrvenog obojenja, koje je nastalo od koloidno dispergiranog srebra, meri se spektrofotometrijski.
Stakleno posuđe, aparatura i ostali pribor
1) Graduisane pipete, zapremine 1, 5, 10, 20 ml.
2) Menzure, zapremine 5, 10, 50, 100 ml.
3) Odmerne tikvice zapremine 200 ml.
4) Aparatura za određivanje arsena.
5) Spektrofotometar.
Reagensi
Kao reagensi upotrebljavaju se hemikalije što je moguće višeg stepena čistoće.
1) 20%-na v/v sumporna kiselina (H2SO4).
2) Piridin p.a.
Napomena:
Piridin je toksičan i neprijatnog mirisa, pa zbog toga njime treba rukovati pažljivo i u digestoru s dobrom ventilacijom.
3) Rastvor srebro-dietil-ditiokarbamata (Ag–DDTC): 1 g srebro-dietil-ditiokarbamata rastvori se u maloj količini piridina, dopuni piridinom do 200 ml i dobro promeša. Rastvor se čuva u dobro zatvorenoj, tamno obojenoj boci, a stabilan je oko 14 dana.
4) Vata za apsorpciju, zasićena olovo-acetatom: 50 g olova-acetat-trihidrata (Pb (C2H3O2)2 3H2O) rastvori se u 250 ml destilovane vode. Dovoljna količina vate zasiti se tim rastvorom, ostavi da se višak rastvora ocedi i zatim osuši pod vakuumom na sobnoj temperaturi. Tako pripremljena vata za apsorpciju čuva se u dobro zatvorenoj boci.
5) Rastvor kalijum-jodida (KJ): 16,5 g kalijum-jodida rastvori se u destilovanoj vodi i dopuni destilovanom vodom do 100 ml.
Rastvor se čuva u tamnoj boci, a stabilan je tri dana.
6) Rastvor kalaj (II) hlorida (SnCl2 · 2H2O) (rastvor II) hlorida rastvori se u 100 ml koncentrovane hlorovodonične kiseline (NCl min. 36%).
Rastvor je stabilan tri meseca.
7) Cink u obliku granula.
8) Rastvor natrijum-hidroksida: 20 g natrijum-hidroksida (NaOH) rastvori se u destilovanoj vodi i dopuni vodom do 100 ml.
9) Standardni rastvor arsena: u odmernu tikvicu zapremine 100 ml odmeri se 0,1320 g arsen-trioksida (As2O2) prethodno osušenog iznad sumporne kiseline i rastvori u približno 5 ml rastvora natrijum-hidroksida. Rastvor se neutrališe 10%-nom v/v sumpornom kiselinom i doda još 10 ml kiseline u višku, a zatim se dopuni sveže prokuvanom i ohlađenom destilovanom vodom do oznake (rastvor I). U drugu odmernu tkvicu, zapremine 1000 ml otpipetira se 10 ml rastvora I, doda 10 ml 10%-ne v/v sumporne kiseline i dopuni sveže prokuvanom i ohlađenom destilovanom vodom do oznake (rastvor II). Čuva se u tamnoj boci sa brušenim čepom, a stabilan je tri dana (l ml odgovara l µg arsena).
Postupak
Odgovarajuća količina ekstrakta uzorka sa 1–5 µg arsena otpipetira se u tikvicu A, doda se 20 ml 20%-ne v/v sumporne kiseline 2 ml rastvora kalijum-jodida, 0,5 ml rastvora kalaj (II) hlorida i promeša.
Smesa se ostavi da stoji 30 minuta. Posle toga doda se 3 g cinka u granulama i zatvori nastavcima, od kojih je u prvom (AD1) vata navlažena olovo-acetatom, a u drugom (AD2) 5 ml rastvora srebro-dietil-ditiokarbamata. Aparatura se drži 45 minuta na sobnoj temperaturi i pažljivo meša u intervalima od 10 minuta. Posle završene reakcije odstrane se nastavci, a rastvor srebro-dietil-ditiokarbamata prenese u kivetu promera l cm i izmeri apsorbancija kod 525 mm, uz slepu probu. Slepa proba sa svim reagensima, osim rastvora uzorka, provede se kroz sve faze opisanog postupka. Vrednost za eventualni sadržaj arsena u uzorku dobija se ekstrapolacijom iz baždarne krive.
Baždarna kriva
Baždarna kriva priprema se tako što se u šest aparatura za arsen otpipetira: 0,5; 1,0; 2,0; 3,0; 5,0 i 10,0 ml rastvora II, i pripremi za već opisani postupak, a odnos između uzetih mikrograma arsena i intenziteta boje prikaže se grafički. Osetljivost metode iznose 0,1 µg arsena u zapremini od 5 ml.
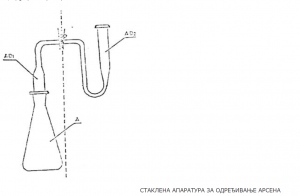
4. Određivanje količine olova
Princip
Količina olova određuje se u kiselom ekstraktu vezivanjem olova u olovni ditizonat. Intenzitet nastalog ružičastog obojenja, koji je proporcionalan koncentraciji olova meri se spektrofotometrijski. Joni koji smetaju uklanjaju se kompleksiranjem s amonijum-citratom, hidroksilamin-hidrohloridom i kalijum-cijanidom.
Stakleno posuđe, aparatura i ostali pribor
1) Odmerne tikvice zapremine 25, 100, 500 i 1000 ml.
2) Elenmajer-tikvice, zapremine 100, 250 i 500 ml.
3) Levkovi za odvajanje, zapremine 100, 250, 500 i 1000 ml.
4) Menzure, zapremine 10, 50, 100, 250 i 500 ml.
5) Graduisane pipete, zapremine 1, 2, 5, 10, 25 i 50 ml.
6) Spektrofotometar.
Reagensi
Kao reagensi upotrebljavaju se reagensi što je moguće višeg stepena čistoće.
1) Amonijum-hidroksid, koncentrovani (NH4OH) – minimalno 25% NH3.
2) Hloroform (CHCl3) p.a.
3) Tetrahlor-ugljenik (CCl4) p.a.
4) Hlorovodonična kiselina, kocentrovana (HCl) – minimalno 36% HCl.
5) Rastvor hlorovodonične kiseline (HCl): 50 ml koncentrovane hlorovodonične kiseline pomeša se s 50 ml destilovane vode.
6) Rastvor ditizona (C6H5N : N.CS.NH.NH.C6H1) u hloroformu: 20 mg ditizona rastvori se u 100 ml čistog hloroforma. Prenese se u levak za odvajanje, zapremine 500 ml, doda se 150 ml destilovane vode i 2 do 3 ml koncentrovanog NH4OH. Snažno se promućka i posle odvajanja, hloroformski sloj se baci. Doda se 100 ml hloroforma, zakiseli se rastvorom hlorovodonične kiseline (kongocrveni papir), snažno se promućka i vodeni sloj baci. Hloroformska faza se ispere sa 2h25 ml destilovane vode. Vodena faza se baci, a hloroformski ekstrakt ditizona čuva se u tamnoj boci.
7) Rastvor ditizona (rastvo A): 50 mg ditizona rastvori se u 1000 ml tetrahlor-ugljenika. Čuva se u tamnoj boci.
8) Rastvor ditiozna (rastvor V): 200 ml rastvora (rastvor A) razredi se do 1000 ml s tetrahlor-ugljenikom. Taj rastvor se priprema neposredno pre upotrebe.
9) Rastvor limunske kiseline (C6H8O7 H2O): 20 g limunske kiseline rastvori se i dopuni destilovanom vodom do 100 ml.
10) Rastvor natrijum-citrata (C6H5Na3O7 . 2H2O): 147 g natrijum-citrata rastvori se u destilovanoj vodi i dopuni vodom do 500 ml. Prenese se u levak za odvajanje zapremine 1000 ml, doda 0,5 ml koncentrovanog NH4OH i 50,0 ml rastvora ditizona u hloroformu. Snažno se promućka i ditizonski sloj se baci. Ekstrakcija se ponavlja sa po 10 ml ditizona u hloroformu i 40 ml hloroforma, dok poslednji ditizonski ekstrakt ne ostane zelen. Ditizonski sloj se baci, a vodenom sloju se doda 5 ml rastvora limunske kiseline. Vodena faza se ekstrahuje sa po 50 ml hloroforma, dok hloroformski sloj ne postane bezbojan. Hloroformski sloj se baci. Reagens se čuva u polietilenskoj boci.
11) Rastvor natrijum-metabisulfita (Na2S2O5): 5 g natrijum-metabisulfita rastvori se i dopuni destilovanom vodom do 100 ml. Filtrira se po potrebi. Rastvor je stabilan nedelju dana.
12) Metil-crveno(i): 20 mg metil-crvenoga rastvori se u 70 ml apsolutnog etanola i dopuni destilovanom vodom do 100 ml.
13) 10 mol/l amonijum-hidroksida (NH4OH).
14) 0,1 mol/l hlorovodonične kiseline (NCl).
15) Rastvor hlorovodonične kiseline – natrijum-citrata: 2,5 ml rastvora natrijum-citrata pomeša se s 100 ml 0,1 mol/l hlorovodonične kiseline.
16) Azotna kiselina koncentrovana (HNO3) – minimalno 65% NHO3.
17) Rastvor azotne kiseline (HNO3) rastvor (I): 50 ml koncentrovane azotne kiseline pomeša se s 50 ml destilovane vode.
18) Rastvor azotne kiseline (HNO3) rastvor (II): 1 ml koncentrovane azotne kiseline pomeša se s 100 ml destilovane vode.
19) Rastvor amonijum-citrata (C6H14N2O7): 50 g amonijum-citrata rastvori se u 100 ml destilovane vode. Rastvoru se dodaje koncentrovan NH4OH do pH vrednsoti 9,0 i mućka s rastvorom ditizona (rastvor A) dok se olovo potpuno otkloni. Višak ditizona ukloni se sa CCl4.
20) Timol-plavo (i): 50 mg timol-plavoga rastvori se u 70 ml apsolutnog etanola i dopuni destilovanom vodom do 100 ml.
21) Rastvor kalijum-cijanida (KCN): 10 g kalijum-cijanida rastvori se i dopuni destilovanom vodom do 100 ml.
Napomena:
Kalijum-cijanid je toksičan. Zbog toga njima treba rukovati pažljivo i u digestoru s dobrom ventilacijom.
22) Rastvor hidroksilamin-hidrohlorida (H4ClNO): 20 g hidroksilamin-hidrohlorida rastvori se i dopuni destilovanom vodom do 100 ml.
23) Rastvor amonijum-hidroksida (NH4OH): 50 ml koncentrovanog amonijum-hidroksida pomeša se sa 50 ml destilovane vode.
24) 8 mol/l amonijum-hidroksid (NH4OH).
25) Rastvor amonijum-hidroksid-cijanid-sulfita: 725 ml 8,0 mol/l NH4OH pomeša se sa 30 ml rastvora kalijum-cijanida i dopuni destilovanom vodom do 1000 ml. Rastvoru se doda 1,5 g natrijum-sulfita (Na2SO3) i dobro promeša.
26) Standardni rastvor olova (Pb): 0,1598 g osušenog olova-nitrata Pb (NO3)2 rastvori se u 50 ml rastvora azotne kiseline (rastvor I) i dopuni istom kiselinom do 100 ml (rastvor A). 10 ml tog rastvora otpipetira se u odmernu tikvicu zapremine 100 ml i dopuni istim HN03 do oznake (rastvor V). U odmernu tikvicu zapremine 100 ml otpipetira se 10 ml rastvora V i dopuni istim HNO3 do oznake (rastvor C). 10 ml rastvora C dopuni se do 100 ml istim HNO3 (rastvor D). 1 ml tog rastvora sadrži 1 µg olova.
Postupak
U levak za odvajanje, zapremine 250 ml, otpipetira se alikvot uzorka koji sadrži 20 do 100 µg olova. Doda se 10 ml rastvora natrijum-citrata, 0,5 ml rastvora natrijum-metabisulfita i 0,2 ml metil-crvenog (i). Rastvor se neutrališe s 10 mol/l NH4OH, ohladi i metil-crveno se odstrani iz rastvora ekstrakcijom s 2h5 ml hloroforma. Hloroformski sloj se baci. Zatim se doda 5 ml hloroforma i 1 ml rastvora ditizona u hloroformu. Dodaje se 10 mol/l NH4OH po 0,1 ml, mućkanjem posle svakog dodavanja, dok se boja ditizona ne promeni od zelene do svetloružičaste, a zatim se doda 0,1 ml 10 mol/l NH4OH u višku. Mućka se 15 sekundi i dodaje po 1 ml rastvora ditizona u hloroformu, dok se posle poslednjeg dodavanja i mućkanja boja ditizonskog sloja ne promeni od ružičaste do zelene, zbog viška ditizona. Mućka se 15 sekundi i ostavi da se slojevi odvoje. Ditizonski sloj se prenese u drugi levak za odvajanje. Vodeni sloj u prvom levku se ispere bez mućkanja s nekoliko mililitara hloroforma i hloroformski sloj se doda glavnom ekstraktu. Vodenoj fazi u prvom levku doda se 2 ml hloroforma, 1 ml ditizona u hloroformu, mućka se 15 sekundi i ostavi da se slojevi odvoje. Ditizonski sloj mora biti zelen. Ako je taj sloj ružičast, ekstrakcija je nepotpuna i treba dodavati po 1 ml rastvora ditizona u hloroformu sve dok ditizon ne bude u višku. Ditizonski sloj se doda glavnom ekstraktu, a vodeni sloj se ispere s nekoliko mililitara hloroforma.
Združena ditizonska faza dalje se ekstrahuje, jer je u njoj zastupljeno olovo. U tom slučaju se uz olovo mogu naći i bakar i cink. Bakar se odvaja ekstrakcijom ditizonskog sloja s 2h20 ml rastvora hlorovodonične kiseline – natrijum-citrata, mućkanjem po 30 sekundi. U kiselom vodenom sloju ostaju olovo i cink, a ditizonski sloj sadrži bakar.
Kiselom vodenom sloju doda se 10 ml rastvora amonijum-citrata, nekoliko kapi timol-plavog (i) i 1 ml rastvora hidroksilamin-hidrohlorida. Rastvoru se dodaje koncentrovan NH4OH do pH vrednosti 8,5 i doda se 5 ml rastvora kalijum-cijamida. Ca NH4OH podesi se pH na 9,0-9,5 (plava boja indikatora). Proveri se pH vrednost na pH papiru. Doda se 5 ml rastvora ditizona (rastvor A) i mućka. Pričeka se da se slojevi odvoje i donji sloj se prense u drugi levak za odvajanje. Ekstrakcija se ponovi sa 2h5 ml rastvora ditizona (rastvor A) i ditizonski ekstrakti se združe. Poslednji ditizonski sloj ne sme biti crven; ako je crven, ekstrakcija se nastavlja dok ditizon ne dobije zelenu boju. Združeni ditizonski ekstrakt mućka se s 10 ml destilovane vode koja sadrži jednu kap rastvora NH4OH. Ditizonski sloj se prenese u novi levak za odvajanje, a vodeni sloj se mućka sa 1 do 2 ml CCl4. Taj sloj CCl4 doda se ditizonskom sloju.
Ditizonskom sloju doda se 5 ml rastvora HNO3 (rastvor II) i mućka 30 sekundi. Slojevi se odvoje i, ako je potrebno, ekstrakcija ponovi sa 3h5 ml iste HNO3. Vodene faze se sakupe u odmernoj tikvici zapremine 25 ml. Ako je u vodenom sloju zastupljen CCl4 u obliku masnih mrlja, tikvice se postave u vodeno kupatilo da CCl4 ispari. Ohladi se i do oznake dopuni istom azotnom kiselinom. To je rastvor za spektrofotometrijsko određivanje olova (videti napomenu).
U levak za odvajanje, zapremine 100 ml otpipetira se alikvot dobijenog rastvora. Ako je potrebno, doda se rastvor azotne kiseline (rastvor II) do zapremine 10 ml, a zatim se doda 10 ml rastvora amonijum-cijanid-sulfita i 10 ml rastvora ditizona (rastvor V). Mućka se 30 sekundi. Ako je ditizonski sloj bistar, mere se apsorbancije uzorka i slepe probe kod 520 nm uz CCl4, u kiveti promera 1 cm.
Ako je ditizonski sloj mutan, filtrira se preko staklene vune. Uporedo se radi slepa proba sa svim reagensima i provede se kroz sve faze opisanog postupka, s tom razlikom što se, umesto uzorka, otpipetira ista količina 0,1 mol/l hlorovodonične kiseline.
Baždarna kriva
Baždarna kriva priprema se tako što se u levkove za odvajanje, zapremine 100 ml otpipetira 1, 2, 3, 6, 8 i 10 ml standardnog rastvora olova (rastvor D), što odgovara 1,0, 2,0, 4,0, 6,0, 8,0, i 10,0 ng olova. Gde je to potrebno, doda se rastvor HNO3 (rastvor II) do zapremine 10 ml. Posle toga doda se 10 ml rastvora amonijum-cijanid-sulfita i primeni već otpisani postupak. Odnos između uzetih mikrograma olova i intenziteta boje nastalog kompleksa prikazuje se grafički. Koncentracija olova u uzorku izračunava se pomoću baždarne krive.
Osetiljivost metode iznosi 1 µg olova u zapremini od 10 ml.
Napomena: Zatupljenost bizmuta, koji utiče na određivanje olova, dokazuje se u rastvoru NHO3 (rastvor II). Alikvotu tog rastvora podesi se pH vrednost koncentrovanim NH4OH na 2,0, doda se 2 do 3 ml rastvora ditizona (rastvor V) i snažno mućka 2 minuta. Ako ditizon ne menja boju, bizmut nije zastupljen. Narandžasta boja ditizona ukazuje na prisustvo bizmuta, koji mora biti otklonjen. Ukupnom rastvoru pH vrednost podesi se na 2,0 i ekstrakcija ponavlja s 2 do 3 ml rastvora ditizona (rastvor V) dok poslednji ekstrakt ne ostane zelen. Konačno se vodenom rastvoru pH vrednost podesi na 10,8 posle dodavanja rastvora amonijum-cijanid-sulfita. Određivanje se nastavalja na način koji je opisan za uzorak.
5. Određivanje količine hroma
Princip
Količina hroma određuje se posle ekstrakcije tako što se hrom oksidira u hromat, koji reaguje sa difenil-karbazidom. Intenzitet nastalog crvenoljubičastog obojenja meri se spektrofotometrijski.
Stakleno posuđe, aparatura i ostali pribor
1) Odmerne tikvice, zapremine 50, 100 i 1000 ml.
2) Graduisane pipete, zapremine 1, 5, 10 i 25 ml.
3) Menzure, zapremine 50 i 100 ml.
4) Električno vodeno kupatilo sa termoregulacijom.
5) Spektrofotometar.
Reagensi
Kao reagensi upotrebljavaju se hemikalije što je moguće višeg stepena čistoće.
1) 5%-na v/v sumporna kiselina (H2SO4).
2) 0,02 mol/l kalijum-permanganat (KMnO4).
3) Fosforna kiselina (H3PO4 minim. 85%-na).
4) Rastvor natrijum-azida (NaN3): 5 g natrijum-azida rastvori se u vodi i dopuni vodom do zapremine 100 ml.
5) Rastvor difenil-karbazida: 0,25 g sim. difenil-karbazida (C6H5 NH NH CO NH C6H5) i 4 g anhidrida ftalne kiseline (C8H4O3) rastvori se u 100 ml 95%-nog etanola. Reagens je stabilan nekoliko meseci ako se čuva na hladnom mestu.
6) Rastvor amonijaka minim. 25% (NH3).
7) Standardni rastvor hroma: 0,0283 g kalijum-bihromata (K2Cr2O7) odmeri se u odmernu tikvicu zapremine 1000 ml, rastvori u malo destilovane vode i dopuni tom vodom do oznake (rastvor I). U odmernu tikvicu zapremine 100 ml otpipetira se 10 ml rastvora I i dopuni destilovanom vodom do oznake (rastvor II).
1 ml odgovara 1 µg hroma.
Postupak
Odgovarajuća količina ekstrakta uzorka sa 1 do 10 µg hroma otpipetira se u čašu, zapremine 100 ml, neutrališe se rastvorom amonijaka minim. 25% doda se 10 ml rastvora sumporne kiseline, 0,4 ml fosforne kiseline i, kap po kap, u rastvor kalijum-permanganata do ružičaste boje. Sve to greje se u vodenom kupatilu 20 minuta. Višak rastvora kalijum-permanganata ukloni se dodavanjem rastvora natrijum-azida. Reagens se dodaje kap po kap i zagreva jedan minut posle svake promene boje (treba izbegavati višak rastvora natrijum-azida). Ohladi se i, ako je potrebno, filtrira u odmernu tikvicu zapremine 50 ml, a filtrir-papir i čašica isperu se destilovanom vodom.
Zatim se u tikvicu otpipetira 4,0 ml rastvora difenil-karbazida i dopuni destilovanom vodom do oznake. Sadržaj u tikvici se promeša i, posle pet minuta, apsorbancija se meri kod 540 nm, u kiveti promera 1 cm, uz slepu probu. Slepa proba sa svim reagensima, osim rastvora uzorka, provede se kroz sve faze opisanog postupka. Vrednost za eventualni sadržaj hroma u uzorku dobije se esktrapolacijom iz baždarne krive.
Baždarna kriva
Baždarna kriva priprema se tako što se u šest odmernih tikvica, zapremine 50 ml, otpipetira 1, 2, 4, 6, 8 i 10 ml rastvora II i primeni isti postupak, a odnos između uzetih mikrograma hroma i intenziteta boje prikaže se grafički.
Osetljivost metode iznosi 1 µg hroma u zapremini od 50 ml.
6. Određivanje količine nikla
Princip
Količina nikla određuje se posle ekstrakcije sa dimetil-glioksimom u jako alkalnom medijumu, uz prisustvo oksidansa. Intenzitet nastalog vinskocrvenog ili mrkog kompleksa meri se spektrofotometrijski.
Stakleno posuđe, aparatura i ostali pribor
1) Čaše, zapremine 50 i 100 ml.
2) Odmerne tikvice, zapremine 10 i 100 ml.
3) Levkovi za odvajanje, zapremine 100 ml.
4) Menzure, zapremine 20 ml.
5) Graduisane pipete, zapremine 1, 2. 5. i 10 ml.
6) Trbušaste pipete, zapremine 5 ml.
7) Kapaljke.
8) Spektrofotometar.
Reagensi
Kao reagensi upotrebljavaju se hemikalije što je moguće višeg stepena čistoće.
1) Rastvor dimetil-glioksima (C4H8N2O2): 1 g dimetil-glioksima rastvori se i dopuni 95%-nim etanolom do 100 ml.
2) Rastvor limunske kiseline (C6H8O7 H2O): 10 g limunske kiseline rastvori se i dopuni destilovanom vodom do 100 ml.
3) Rastvor kalijum-persulfata (K2S2O8): 2 g kalijum-persulfata rastvori se i dopuni destilovanom vodom do 100 ml.
4) Hloroform (CHCl3) p.a.
5) 6 mol/l amonijum-hidroksid (NH4OH).
6) 0,5 mol/l amonijum-hidroksid (NH4OH).
7) 2 mol/l natrijum-hidroksid (NaOH).
8) Standardni rastvor nikla: 0,4048 g nikal-hlorida rastvori se u 0,1 mol/l hlorovodonične kiseline i dopuni istom kiselinom do 100 ml (rastvor I). 10 ml tog rastvora otpipetira se u odmernu tikvicu zapremine 100 ml i dopuni istom hlorovodoničnom kiselinom do oznake (rastvor II). U odmernu tikvicu zapremine 100 ml otpipetira se 10 ml rastvora II i dopuni istom hlorovodoničnom kiselinom do oznake (rastvor III). 1 ml tog rastvora sadrži 10 µg nikla.
Postupak
U 10 do 50 ml ekstrakta, koji ne sme sadržavati više do 400 µg nikla, doda se 5 ml rastvora limunske kiseline (ako je zastupljeno gvožđe II, mora se prevesti u gvožđe III), neutrališe se sa 6 mol/l amonijum-hidroksidom (pH papir) i doda 5 ml kiseline u višku. Rastvor se prenese u levak za odvajanje i razredi destilovanom vodom na 50 do 75 ml. Doda se 5 ml rastvora dimetil-glioksima i po 2 ml na svakih 10 mg bakra, kao i po 5 ml na svakih 10 mg kobalta, ako su oni zastupljeni. Zapremine dodatog rastvora dimetil-glioksima ne sme biti veća od 35% ukupne zapremine. Ekstrahuje se tri puta sa po 5 ml hloroforma i svaki put snažno mućka pola minuta. Sjedinjeni hloroformski ekstrakt mućka se sa 20 ml 0,5 mol/l NH4OH, a faze se odvoje. Vodena faza mućka se sa 5 ml hloroforma, koji se posle odvajanja doda već ispranom hloroformskom ekstraktu. Ako uzorak sadrži više od 50 mg bakra, ispiranje se mora ponoviti još jedanput sa 0,5 mol/l NH4OH.
Da bi se nikal preveo u vodenu fazu, hloroformski ekstrakt mućka se dva puta po jedan minut sa 5 ml 1 mol/l hlorovodonične kiseline. Kiseli rastvor se prenese u odmernu tikvicu zapremine 100 ml, razredi destilovanom vodom do 50 ml, doda 1 ml rastvora limunske kiseline, 3 ml rastvora kalijum-persulfata, 15 ml 2 mol/l natrijum-hidroksida i 1 ml rastvora dimetil-glioksima. Zagreje se na temperaturi od 58°S i održava pet minuta na temperaturi od 60 do 70°S. Ohladi se na sobnoj temperaturi i dopuni destilovanom vodom do 100 ml. Apsorbancija se meri pri talasnoj dužini od 465 nm, uz slepu probu, koja se priprema po istom postupku. Ako uzorak sadrži manje od 100 µg nikla, preporučuje se kiveta promera 4 cm. Kad se određuju male količine nikla, smanji se volumen 1 mol/l HCl za prevođenje nikla u vodenu fazu u 5 ml, a ostali reagensi u odgovarajućoj srazmeri, tako da konačna zapremina iznosi 10 ml.
Baždarna kriva
Baždarna kriva priprema se tako što se u levkove za odvajanje, zapremine 100 ml, otpipetira po 0,1 ml, 0,2 ml i 0,3 ml standardnog rastvora III, što o dgovara 1 µg, 2 µg i 3 µg nikla, doda se 10 ml 0,1 mol/l hlorovodonične kiseline, i postupak se izvede na već opisani način. Odnos između uzetih mikrograma nikla i intenziteta boje stvorenog kompleksa prikazuje se grafički.
Osetljivost metode iznosi 0,1 µg nikla u zapremini od 10 ml.
V. Metode atomsko-apsorpcione spektrofotometrije
(alternativne metode)
I. Određivanje žive i arsena
1. Princip
1.1. Tehnika hladnih para
Tehnika hladnih para primenjuje se za određivanje žive. Zasniva se na redukciji žive iz rastvora uzorka do elementarnog stanja sa kalaj-hloridom. Za redukciju se može upotrebiti natrijum-bor-hidrid (NaBH4) ako se koristi aparat koji ima takav program. Strujom inertnog gasa ili vazduha unose se živine pare u kvarcnu kivetu, gde se apsorbuje karakteristično zračenje žive iz odgovarajućeg izvora.
1.2. Tehnika razvijanja hidrida
Tehnika razvijanja hidrida primenjuje se najčešće za određivanje elemenata: arsena, selena, kalaja, bizmuta, telura, germanijuma i antimona. Zasniva se na redukciji elementa iz rastvora natrijum-bor-hidridom do stvaranja isparljivog hidrida. Struja inertnog gasa unosi hidrid u zagrejanu kvarcnu ćeliju, gde se na temperaturi od 200 do 1000°S hidrid razlaže i apsorbuje karakteristično zračenje elementa, koje se određuje iz odgovarajućeg izvora.
2. Reagensi
Kao reagensi koriste se hemikalije čistoće pro–analysi i destilovana voda ili voda odgovarajuće čistoće. Rastvore osnovnih standarda treba pripremati na sledeći način:
2.1. Arsen, 1000 µg/ml
Rastvori se 1,320 g arsen-trioksida (AS2O3), u 25 ml 20% (m/v) kalijum-hidroksida. Neutralizuje se sa 20% (v/v) sumpornom kiselinom, uz fenol-ftalein kao indikator. Dopuni se do zapremine 1000 ml 1%-nom (v/v) sumpornom kiselinom.
2.2. Živa, 1000 µg/ml
Rastvori se 1,080 g žive (II) oksida (HgO), u minimalnoj količini hlorovodonične kiseline (1+1). Dopuni se do 1000 ml dejonizovanom vodom.
Radni standardi, koji se koriste za kalibraciju instrumenata ili za izradu baždarnog dijagrama, dobijaju se razređivanjem osnovnog standarda dejonizovanom vodom.
3. Aparati i pribor
Pored uobičajenog laboratorijskog pribora koristi se atomsko-apsorpcioni spektrofotometar, po mogućnosti pisač i dodatak za određivanje žive ili dodatak za određivanje elemenata koji stvaraju lako isparljive hidride. Uslovi merenja podešavaju se prema uputstvu proizvođača, uz specifikaciju sledećih radnih parametara:
– talasne dužine;
– slita;
– izvora zračenja;
– temperature kvarcne ćelije;
– doziranja reagensa za redukciju.
4. Postupak
Za kalibraciju instrumenta i izradu baždarnog dijagrama koriste se radni standardi dobijeni razređivaanjem osnovnog standarda.
Uzorak se priprema prema propisu „Priprema uzorka za određivanje toksičnih metala i nemetala metodom ekstrakcije”.
Prema očekivanoj koncentraciji elementa u uzorku, kao i prema prirodi uzorka, tj. sklonosti penjenju (stvaranju pene), u postupku merenja može se uzeti 1 do 10 ml rastvora uzorka, a ponekad i više.
Da bi se sprečilo penjenje, preporučuje se dodavanje antipenušavca. Ako ne pstoji mogućnost za direktno očitavanje koncentracije određivanog elementa s instrumenta, na osnovu korišćenja jednog ili više standarda, potrebno je iz podataka za apsorbenciju, uz pomoć baždarnog dijagrama, na uobičajeni način izračunati sadržaj žive ili arsena.
II. Određivanje nikla, hroma, kadmijuma, olova i barijuma
1. Princip
1.1. Plamena atomsko-apsorpciona spektrofotometrija
Plamena atomsko-apsorpciona spektrofotometrija primenjuje se za određivanje nikla, kadmijuma, olova, barijuma i dr. Zasniva se na uvođenju rastvora uzorka u plamen i određivanju sadržaja ispitivanog elementa merenjem apsorpcije karakterističnog zračenja iz odgovarajućeg izvora.
1.2. Tehnika grafitne kivete (NGA)
Tehnika grafitne kivete primenjuje se za određivanje nikla, hroma, kadmijuma, olova, barijuma, arsena i žive u tečnim uzorcima, a retko – i u čvrstim uzorcima. Tehnika grafitne kivete zasniva se na atomizaciji, programiranim električnim zagrevanjem uzorka u grafitnoj kiveti, u struji inertnog gasa.
2. Reagensi
Za pripremanje reagensa upotrebljavaju se hemikalije čistoće pro analysi i destilovana voda ili voda odgovarajuće čistoće.
Osnovni standardi za pojedine elemente pripremaju se na sledeći način:
2.1. Barijum, 1000 µg/ml
Rastvori se 1,437 g barijum-karbonata (BaCO3) u minimalnoj količini hlorovodonične kiseline (1+1). Dopuni se do 1000 ml 1%-nom (v/v) hlorovodoničnom kiselinom.
2.2. Kadmijum, 1000 µg/ml
Rastvori se 1,000 g metalnog kadmijuma u minimalnoj zapremini hlorovodonične kiseline (1+1). Dopuni se do 1000 ml 1%-nom (v/v) hlorovodoničnom kiselinom.
2.3. Hrom, 1000 µg/ml
Rastvori se 3,735 g kalijum-hromata (K2CrO4) u 1000 ml dejonizovane vode.
2.4. Olovo, 1000 µg/ml
Rastvori se 1,598 g olovo-nitrata Pb (NO3)2 u 1% (v/v) HNO3 i dopuni se 1% (v/v) HNO3 do 1000 ml. Radni standardi, koji se koriste za kalibraciju instrumenta ili izradu baždarnog dijagrama, dobijaju se razređivanjem osnovnog standarda dejonizovanom vodom.
3. Aparati i pribor
Pored uobičajenog laboratorijskog pribora, upotrebljava se atomsko-apsorpcijski spektrofotometar sa odgovarajućim priborom, podešen prema uputstvu proizvođača, uz specificiranje sledećih radnih parametara:
– talasne dužine;
– slita;
– izvora zračenja;
– tipa plamena;
– korišćenja „background” korektora (BG).
4. Postupak
Uzorak se priprema prema propisu „Priprema uzorka za određivanje toksičnih metala i nemetala metodom ekstrakcije”. Ako ne postoji mogućnost za direktno očitavanje koncentracije elemenata sa instrumenta, na osnovu korišćenja jednog standarda ili više standarda, potrebno je, iz podataka za apsorbanciju, uz pomoć baždarnog dijagrama, na uobičajeni način izračunati sadržaj elementa koji se određuje.
U ekstremnim slučajevima, kad postoji razlika u hemijskim, a naročito u fizičkim svojstvima (viskoznost, gustina, površinski napon) između uzorka i standarda, preporučuje se metoda standardnog dodatka.
Pri određivanju barijuma moguća je jonizacijska interferencija, koja se uklanja dodavanjem rastvora alkalne soli (1000–2000 µg/ml) u standarde i rastvor uzorka.
G. Metode za određivanje mikrobiološke ispravnosti sredstava za održavanje lične higijene, negu i ulepšavanje lica i tela
I. Pripremanje uzorka
1. Proizvodi koji se mešaju s vodom
Izmeri se 10 g (10 ml) uzorka ili ceo uzorak (ali ne manje od 2 g) ako je manji od 10 g (10 ml), u Erlenmajer-tikvicu i pripremi se razređenje 10–1m fiziološkim rastvorom ili puferisanim rastvorom peptona (36).
2. Proizvodi koji se ne mešaju s vodom
Izmeri se 10 g (10 ml) uzorka ili ceo uzorak (ali ne manje od 2 g), ako je manji od 10 g (10 ml), u Erlenmajer-tikvicu sa staklenim kuglicama.
Puferski rastvor peptona ili fiziološki rastvor s 1%-nim pogodnim emulgatorom, za koji je utvrđeno da ne utiče na rezultat ispitivanja, zagrejan na temperaturi od 40°S, dodaje se dok se ne dobije razređenje 10–1, uz mućkanje oko 10 minuta (ne duže od 15 minuta). Može se dodati, ako je potrebno, i više emulgatora, ali najviše do 10%.
Pre ispitivanja, svi čvrsti uzorci moraju se isitniti.
II. Postupak za utvrđivanje prisustva i izolovanja i identifikaciju mikroorganizama
1. Određivanje ukupnog broja mezofilnih aerobnih bakterija i ukupnog broja kvasaca i spora plesni
Otpipetira se po 1 ml od svakog pripremljenog razređenja u četiri Petrijeve ploče i odmah se u dve Petrijeve ploče sipa po 15 ml otopljenog i na temperaturi od 40 do 45°S ohlađenog hranljivog agara (1).
Ove ploče se inkubiraju dva dana na temperaturi od 35 do 37°S, a zatim još dva dana na temperaturi od 20 do 25°S.
U druge dve Petrijeve ploče sipa se po 15 ml Sabouraud maltoznog agara (27), ohlađenog na temperaturi od 40 do 45°S i dobro promeša. Pošto podloga očvrsne ploče se inkubiraju pet dana na temperaturi od 24 do 26°S.
Posle inkubacije, izbroje se izrasle kolonije, za koje je utvrđeno da su bakterije, odnosno kvasci ili plesni, i broj izraslih kolonija pomnoži faktorom razređenja i podeli brojem upotrebljenih Petrijevih ploča. Dobijena vrednost predstavlja ukupan broj mezofilnih aerobnih bakterija, odnosno ukupan broj kvasaca i plesni u 1 g (1 ml) uzorka. Prisustvo kvasca potvrđuje se preparatom po Gramu.
2. Izolovanje i identifikacija koagulaza pozitivnih stafilokoka
Otpipetira se 1 ml pripremljenog razređenja 10–1 u 9 ml slanog bujona sa 10%-nim natrijum-hloridom (21) i inkubira 24 do 48 časova na temperaturi od 35 do 37°S.
Posle inkubacije, ezom se preseje na površinu ETGP agara po Baird Parkeru (22) ili na krvni agar (35).
Zasejane podloge se inkubiraju 24 do 48 časova na temperaturi od 35 do 37°S. Izrasle kolonije, karakteristične za koagulaza pozitivne stafilokoke, proveravaju se na sposobnost koguliranja plazme, odnosno na prisutnost fermenta koagulaze (24).
3. Izolovanje i identifikacija Pseudomonas aeruginosa
Otpipetira se 1 ml razređenja 10–1 u 9 ml hranljivog bujona (2) i inkubira 24 do 48 časova na temperaturi od 35 do 37°S.
Posle inkubacije, preseje se ezom na površinu Cetrimid agara (37) ili hranljivog agara (1). Podloga se inkubira 24 časa na temperaturi od 35 do 37°S. Sumnjive kolonije testiraju se na prisustvo citrohrom-oksidaze. Kolonije sa pozitivnim oksidaznim testom preseju se na podlogu za određivanje pigmenata piocijanina King A (38) i fluorescina King V (39) i na kosi agar (8). Podloge King A i King V inkubiraju se 24 časa na 42°S u vodenom kupatilu.
Karakteristične reakcije ukazuju na prisustvo bakterija Pseudomonas aeruginosa.
4. Izolovanje i identifikacija Escherichia coli
Jedan mililitar razređenja 10–1 zaseje se u epruvete sa brilijantzelenim laktoza žučnim bujonom (15) pomoću Dyrhamovih cevčica i inkubira 24 do 48 časova na temperaturi 44°S. Ako se inkubacija obavlja u termostatu sa zagrejanim vazduhom, podlogu treba prethodno zagrejati na 44°S u vodenom kupatilu.
Stvaranje gasa u Durhamovim cevčicama posle 24 do 48 časova označava da je u podlozi došlo do porasta Escherichie coli.
Iz epruveta sa pozitivnim rastom, sadržaj se ezom presejava na površinu ljubičastocrvenog žučnog agara (16) ili eozin-metilen-plavog agara (40) i inkubira 24 do 48 časova na temperaturi 44°S. Karakteristične laktoza pozitivne kolonije preseju se na dvostruki šećer po Kligeru (9) i inkubiraju 18 do 24 časa na temperaturi 35 do 37°S.
Kulture svojstava karakterističnih za Escherichiy coli identifikuju se kratkim biohemijskim nizom. Kulture se presejavaju na peptonsku vodu za indol (13), podlogu za ureu (10), podlogu za izvođenje MR (Metil red) (17 i 18) i VP (Voges–Proskayer) ogleda (17 i 19) i podlogu za dokazivanje korišćenja citrata po Simonsu (20).
Podloge se inkubiraju 24 do 48 časova na temperaturi 35 do 37°S. Karakteristične reakcije ukazuju na prisustvo Escherichia coli.
5. Izlovanje i identifikacija Proteus vrsta
Otpipetira se 1 ml razređenja 10–1 u 9 ml hranljivog bujona (2) i inkubira 18 do 24 časa na temperaturi 35 do 37°S. Posle inkubacije, na površinu SS agara (7) i brilijantzelenog agara (14) ezom se preseje i inkubira 18 do 24 časa na temperaturi 35 do 37°S. Karakteristične kolonije presejavaju se na dvostruki šećer po Klingleru (9) i inkubiraju 18 do 24 časa na temperaturi 35 do 37°S. Kulture sa dvostrukog šećera, osobina karakterističnih za Proteus, identifikuju se dalje kratkim biohemijskim nizom.
Karakteristične reakcije ukazuju na prisustvo Proteus vrsta.
III. Podloge
36. Puferirani rastvor peptona
Sastav:
kalijum-fosfat kiseli 3,56 g
natrijum-fosfat dibazični 7,23 g
natrijum-hlorid 4,3 g
pepton 1,0 g
destilovana voda do 1000 ml
Steriliše se u autoklavu 15 minuta na temperaturi 121°S;
pH vrednost posle sterilizacije treba da iznosi 7,2 ± 0,2
37. Cetrimid agar
Sastav:
penkreatski digerisan želatin 20,0 g
magnezijum-hlorid 1,4 g
kalijum-sulfat 10,0 g
agar 13,6 g
cetrimid 0,3 g
glicerol 10,0 ml
destilovana voda do 1000 ml
Čvrste supstancije se rastvore u vodi, doda se glicerina i zagreva uz mućkanje. Ostavi se da vri jedan minut, dok se potpuno ne rastvori. Posle sterilizacije rN vrednost treba da iznosi 7,2 ± 0,2.
38. King A
Sastav:
pepton 20,0 g
glicerol 10,0 ml
magnezijum-hlorid, bezvodni 1,4 g
kalijum-sulfat, bezvodni 10,0 g
agar 15,0 g
destilovana voda do 1000 ml
Steriliše se u autoklavu 15 minuta na temperaturi 121°S. Posle sterilizacije rN vrednost treba da iznosi 7,2 ± 0,2.
39. King B
Sastav:
proteoza pepton 20,0 g
glicerol 10,0 ml
kalijum-fosfat, bezvodni 1,5 g
magnezijum-sulfat, sa 7H20 1,5 g
agar 15,0 g
destilovana voda do 1000 ml
Steriliše se u autoklavu 15 minuta na temperaturi 121°S. Posle sterilizacije, rN vrednost treba da iznosi 7,2 ± 0,2.
40. Eozin metilen-plavi agar (E.M.V.)
Sastav:
pepton-4. „Torlak” 10 g
laktoza 10 g
kalijum-fosfat 2 g
agar 15 g
eozin Y 0,4 g
metilen-plavo 0,065 g
destilovana voda do 1000 ml
Susptancije se rastvore u vodi, podloga se zagreje do ključanja da se potpuno rastvori, a zatim steriliše u autoklavu 15 minuta na temperaturi 120°S, ohladi na 60°S, dobro promeša i razlije u Petrijeve ploče. Posle sterilizacije, rN vrednost treba da iznosi 7,1 ± 0,2.
Napomena: Navedene podloge sa označenim brojem u zagradi pripremaju se prema recepturi propisanoj u Pravilniku o metodama vršenja mikrobioloških analiza i superanaliza životnih namirnica („Službeni list SFRJ”, br. 25/80).